
La Grippe Saisonnière (Influenza)
grippe saisonnière, influenza A H1N1, influenza B, symptômes grippe, infection virale hiver, fièvre, toux, courbatures, traitement grippe, prévention grippe Maroc, vaccination antigrippale.

doctor
Très bon choix. Voici un article scientifique détaillé que tu peux publier sur ton site, avec des références de revues (revues scientifiques). Je structure l’article de manière rigoureuse (introduction, sections, conclusion), et j’inclus des citations de la littérature (revues) pour appuyer les points.
Introduction
Le microbiote intestinal (ou flore intestinale) est un écosystème complexe de micro-organismes (bactéries, archées, virus, champignons) résidant dans le tractus gastro-intestinal humain. Cet écosystème exerce des fonctions vitales pour l’hôte : digestion des nutriments, modulation du système immunitaire, production de métabolites bioactifs, et maintien de l’homéostasie métabolique. Une altération de ce microbiote, appelée dysbiose, est associée à de nombreuses pathologies, allant des maladies inflammatoires intestinales (MII) aux affections métaboliques (obésité, diabète) et aux désordres immunitaires.
Cet article vise à présenter de manière scientifique mais accessible : (1) la composition et les fonctions du microbiote intestinal, (2) les mécanismes de dysbiose, (3) les conséquences cliniques, (4) les interventions possibles, et (5) les perspectives de recherche.
---
1. Composition et fonctions du microbiote intestinal
1.1 Composition
Le microbiote intestinal comprend des trillions de micro-organismes, principalement des bactéries, mais aussi des virus, des champignons et des archées.
Les bactéries dominantes appartiennent généralement aux phyla Firmicutes et Bacteroidetes, mais la diversité dépend fortement de facteurs individuels (alimentation, âge, mode de vie).
Une partie sous‑étudiée mais importante réside dans l’intestin grêle : le microbiote de l’intestin grêle joue un rôle spécifique dans l’absorption des nutriments et l’immunité locale.
1.2 Fonctions physiologiques
Le microbiote intestinal agit comme un « organe métabolique », selon plusieurs revues récentes :
Métabolisme des nutriments : il aide à fermenter les fibres alimentaires non digestibles, produisant des acides gras à chaîne courte (AGCC ou SCFA) tels que le butyrate, le propionate, et l’acétate, qui nourrissent les cellules épithéliales et modulant le métabolisme.
Barrière intestinale : certaines bactéries renforcent l’intégrité de la barrière épithéliale et participent à la régulation des jonctions serrées, réduisant la perméabilité intestinale.
Immunité : le microbiote joue un rôle central dans la maturation du système immunitaire, notamment via l’induction des lymphocytes T régulateurs (Tregs), l’activation des cellules dendritiques, et la stimulation d’IgA muqueuses.
Communication neuro-immuno-métabolique : les métabolites microbiens (comme les SCFA, les acides biliaires secondaires) interagissent avec des récepteurs du système immunitaire et du système nerveux, influençant l’inflammation systémique et potentiellement l’axe intestin-cerveau.
---
2. Dysbiose : mécanismes et causes
La dysbiose désigne un déséquilibre du microbiote, avec perte de diversité, surcroissance de pathobiontes (micro-organismes potentiellement nuisibles) ou diminution de souches bénéfiques.
2.1 Facteurs de perturbation
Alimentation : un régime pauvre en fibres et riche en sucres simples favorise la dysbiose.
Antibiotiques : les traitements antibiotiques perturbent fortement la composition microbienne, et la reconstitution peut être partielle ou altérée.
Vieillissement : chez les personnes âgées, des modifications du microbiote (qualité et diversité) sont observées, liées à l’inflammation, aux maladies et aux changements de régime alimentaire.
Autres : stress chronique, manque de sommeil, mode de vie sédentaire peuvent également influencer la composition microbienne.
2.2 Mécanismes pathogènes
Les pathogènes opportunistes ou pathobiontes peuvent produire des métabolites pro-inflammatoires, altérer la barrière intestinale et déclencher des réponses immunitaires inappropriées.
La diminution des bactéries productrices de SCFA réduit les signaux anti-inflammatoires et affaiblit la barrière intestinale.
Certaines bactéries peuvent moduler négativement les cellules immunitaires, par exemple en réduisant le nombre de Tregs ou en stimulant des cellules effectrices pro-inflammatoires.
---
3. Implications cliniques de la dysbiose
Une dysbiose du microbiote intestinal est associée à de nombreuses conditions pathologiques :
1. Maladies inflammatoires intestinales (MII) : des profils microbiens altérés sont observés chez les patients atteints de colite ulcéreuse ou de maladie de Crohn.
2. Troubles métaboliques : l’obésité, le diabète de type 2 et d’autres troubles métaboliques sont liés à des altérations de la composition microbienne et des voies métaboliques microbiennes dysrégulées.
3. Maladies auto-immunes : des études montrent des liens entre dysbiose et maladies comme le diabète de type 1, la polyarthrite rhumatoïde, ou d’autres syndromes immunitaires, via des mécanismes inflammatoires et immunomodulateurs.
4. Vieillissement et inflammage (inflamm-aging) : chez les sujets âgés, une dysbiose peut contribuer à un état inflammatoire chronique de bas grade, altérant la santé métabolique et immunitaire.
5. Maladies extra-intestinales : des altérations du microbiote sont aussi impliquées dans des pathologies cardiovasculaires, neuropsychiatriques, et d’autres affections systémiques.
---
4. Interventions thérapeutiques et stratégies de modulation
4.1 Approches diététiques
Promouvoir une alimentation riche en fibres (fruits, légumes, légumineuses, céréales complètes) pour favoriser la production de SCFA.
Utilisation de prébiotiques : ce sont des composés non digestibles (fibres, inuline, fructo-oligosaccharides…) qui stimulent la croissance de bactéries bénéfiques.
4.2 Probiotiques et biotiques
Probiotiques : administration de bactéries vivantes (ex : Lactobacillus, Bifidobacterium) pour rééquilibrer la flore intestinale.
Synbiotiques : combinaison de probiotiques et prébiotiques pour un effet synergique.
4.3 Transplantation de microbiote fécal (TMF)
La fecal microbiota transplantation (FMT) est utilisée dans certaines pathologies, notamment la colite à Clostridioides difficile et est à l’étude pour d’autres maladies liées au microbiote.
Il existe des défis : la biogéographie intestinale (microbiote de l’intestin grêle vs colon) peut rendre l’ingestion de microbiote fécal moins efficace pour certaines zones.
4.4 Stratégies métaboliques et pharmacologiques
Développement de modulateurs métaboliques : certains composés peuvent cibler des enzymes microbiennes pour modifier la production de métabolites (par exemple, inhiber la production de métabolites pro-inflammatoires).
Approches de médecine personnalisée : à l’aide des technologies “multi-omics” (métagénomique, métabolomique), il est possible de concevoir des thérapies ciblées basées sur le profil microbien individuel.
---
5. Perspectives de recherche
La caractérisation plus fine du microbiote de l’intestin grêle est nécessaire, notamment ses rôles spécifiques dans l’absorption et l’immunité.
Le développement de biothérapies avancées, comme des consortiums bactériens synthétiques (microbes “designer”) ou des post-biotiques (métabolites microbiens) ciblés, pourrait révolutionner la médecine.
Les essais cliniques long terme sont essentiels pour évaluer l’efficacité et la sécurité des interventions (probiotiques, TMF, modulaires métaboliques) dans diverses maladies chroniques.
Il faut approfondir la régulation des tests commerciaux de microbiote, car certaines analyses vendues au grand public peuvent manquer de fiabilité, ce qui pose des questions éthiques et scientifiques sur leur interprétation.
---
Conclusion
Le microbiote intestinal n’est plus considéré comme un simple habitant passif du tube digestif : il fonctionne comme un véritable organe métabolique capable d’influencer l’immunité, le métabolisme et même les fonctions neuronales. La dysbiose, en altérant cette symbiose, contribue à de nombreuses maladies. Cependant, grâce aux progrès de la recherche (probiotiques, prébiotiques, transplantation fécale, modulateurs métaboliques), il devient possible de cibler le microbiote pour la prévention et le traitement. L’avenir de la médecine pourrait ainsi être de plus en plus « microbiome‑centré », avec des approches personnalisées basées sur le profil microbien de chaque individu.
Références principales
Lin L, Zhang J. Role of intestinal microbiota and metabolites on gut homeostasis and human diseases. BMC Immunology, 2017.
Valencia S., Zuluaga M., Florian Pérez M.C., Montoya-Quintero K.F., Candamil-Cortés M.S., Robledo S. Human Gut Microbiome: A Connecting Organ Between Nutrition, Metabolism, and Health. International Journal of Molecular Sciences, 2025.
Unraveling the Role of the Human Gut Microbiome in Health and Diseases. Microorganisms, 2024.
The role of gut microbiota in elderly metabolic and inflammatory diseases. Annals of Microbiology, 2024.
The emerging role of metabolites derived from the intestinal microbiota in immune regulation and disease. (Review)

grippe saisonnière, influenza A H1N1, influenza B, symptômes grippe, infection virale hiver, fièvre, toux, courbatures, traitement grippe, prévention grippe Maroc, vaccination antigrippale.

VRS, bronchiolite, infection virale hiver, détresse respiratoire nourrisson, symptômes VRS, virus respiratoire syncytial Maroc, prévention bronchiolite, épidémie VRS.
coronavirus saisonnier, HCoV 229E OC43 NL63 HKU1, SARS-CoV-2, symptômes coronavirus hiver, fièvre, toux, COVID-19, prévention infection virale, virus respiratoire hiver, complications coronavirus.

allergies saisonnières, rhume des foins, pollinoses, symptômes allergie pollen, traitement allergies yeux nez gorge, prévention allergies printemps, antihistaminiques, immunothérapie allergique, congestion nasale, asthme et allergies.
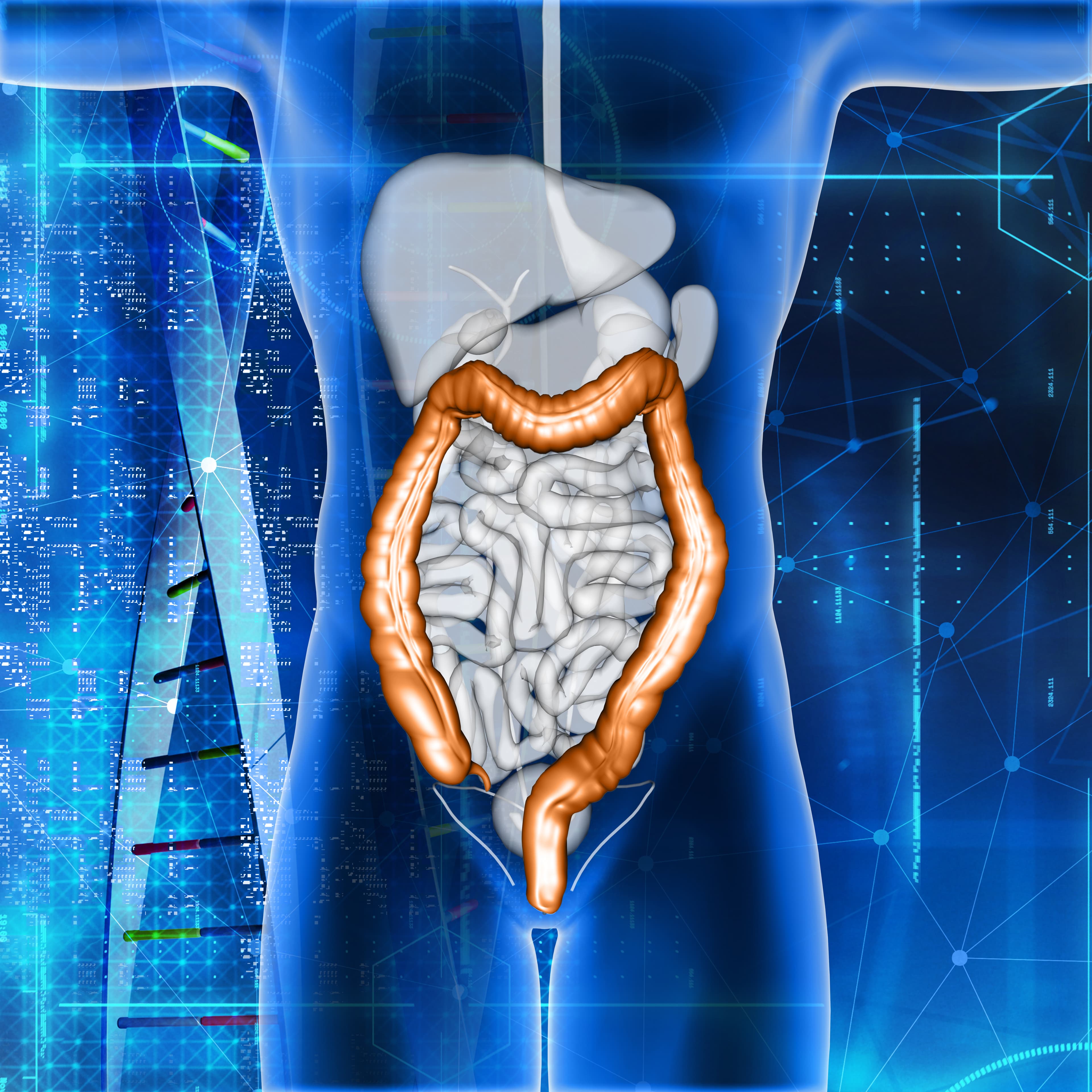
microbiote intestinal flore intestinale dysbiose intestinale santé digestive probiotiques prébiotiques axe intestin-cerveau fermentation intestinale métabolites microbiens intestin et immunité

vieillissement en bonne santé longévité et santé santé des personnes âgées prévention maladies chroniques sarcopénie et vieillissement Alzheimer prévention alimentation santé seniors activité physique

Santé - Alimentation

Dermatologie

Gynécologie - Femme

COVID-19 2025